TF-SPME是什么?
薄膜固相微萃取技术(Thin Film SPME),以下简称TF-SPME, 是以传统Fiber为原型,把吸附相涂在碳网片上的固相微萃取新技术。SPME和TF-SPME都是由滑铁卢大学的加拿大皇家科学院院士Janusz Pawliszyn教授发明,用于分析痕量VOCs和SVOCs等挥发性有机物。

图1:TF-SPME薄膜固相微萃取
TF-SPME与SPME fiber的对比
为了解决SPME fiber有限的吸附容量和萃取速率而开发了TF-SPME技术,TF-SPME通过大大提高了其涂层的表面积/体积比(Surface-volume vadio),不仅增加吸附容量,一定的预平衡时间内具有更高的灵敏度。同样为PDMS涂层,TF-SPME薄膜的表面积比100um SPME fiber的表面积增加了20倍[9]。
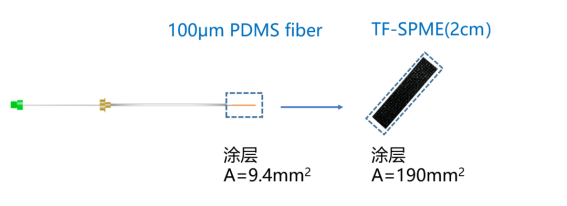
图2:TF-SPME涂层表面积增加20倍[9]
TF-SPME优势汇总
TF-SPME一个突出的特点是吸附相的高表面积/体积比,带来的不仅仅萃取容量和萃取效率的提升,对水基质中萃取极性较强的化合物也有良好的效果,对萃取宽极性范围化合物十分友好。
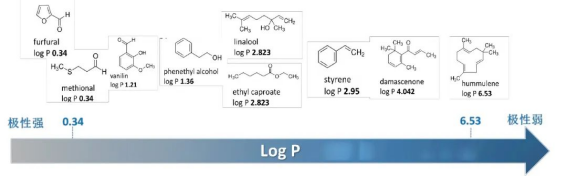
图3:宽极性范围萃取
● 缩短达到平衡所需的时间,萃取效率更高;
● 增大吸附容量,提高灵敏度,降低检出限;
● 适用于极性和非极性的挥发性有机物和半挥发性有机物;(log P从0.34-6.53)
● 机械及化学稳定性好,可以在恶劣环境中现场采样;
● TF-SPME应用场景十分广泛,适用于现场采样、活体采样及常规采样。
● 是一种绿色环保的无溶剂萃取技术。
● 适用于所有标准尺寸的热脱附仪(3.5x1/4’’)。
TF-SPME类型及使用方法
英诺德提供两种规格TF-SPME薄膜,分别是20 x4.7mm和40 x4.7mm。
Part.1 涂层类型及规格
(1) PDMS:非极性VOCs和SVOCs;
(2) PDMS/DVB:挥发性和半挥发性有机物VOCs和SVOCs;
(3) PDMS/HLB:更广泛的极性和非极性挥发性有机物VVOCs、VOCs和SVOCs。
Part.2 HLB涂层是什么?
HLB(Hydrophile Lipophilic Balance)是一种亲水亲油平衡颗粒,由二乙烯基苯结构和N-乙烯基吡咯烷酮骨架结构共聚而成,其特殊结构同时保留非极性化合物和极性化合物[13]。
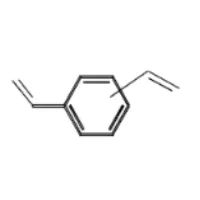
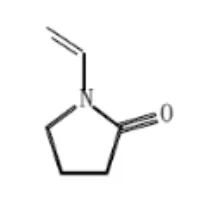
图4:左图为HLB亲油性基团;右图为HLB亲水性基团
Part.3 使用方法
TF-SPME可以从固体、液体、气体中萃取挥发性有机物,是分析痕量挥发性有机物的新利器。
萃取——既可以顶空萃取或直接浸入式萃取,也可以作为被动采样器进行TWA采样。
解析——吸附完成的TF-SPME置于空的脱附管中进行热解析,英诺德生产的TF-SPME薄膜固相微萃取适用于市面上所有标准尺寸的热脱附仪(1/4 x 3.5’’的脱附管)。
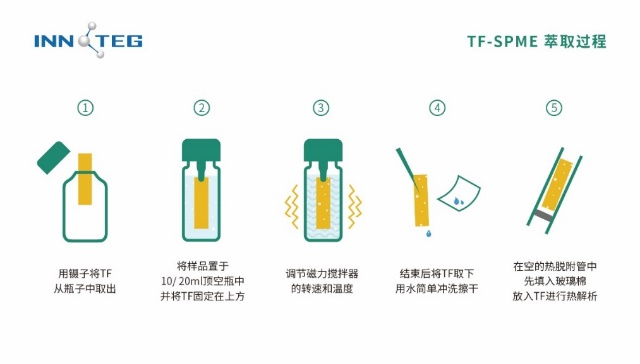
应用汇总
TF-SPME薄膜固相微萃取借助热脱附设备把分析物引GC/GC-MS, 以实现更高的萃取效率和灵敏度,已被广泛应用于食品饮料、酒类、环境(水/空气)、生物样品等中的挥发性有机物分析。
食品
TF-SPME技术高效提取食品饮料(橙汁、葡萄汁、橄榄油、鱼肝油)、酒类(啤酒、葡萄酒)中的各类挥发性香味有机化合物,在一定程度上降低检出限和缩短萃取时间,对把关产品质量和了解不同品种的风味特性以改善食品风味起到了关键作用。

TF-SPME初次被用于测定不同品种的特级初榨橄榄油的风味特性(M.Pilar Segura-Borrego,等人,2020)。(D.Gruszecka,等人,2021)使用PDMS/HLB涂层的TF-SPME直接浸提商业鱼肝油样品,测定5个多氯正构烷烃(PCA)含量,以把关产品质量。
酒类的风味与发酵原料的品质和品种有直接的关系,例如葡萄的芳香成分会影响葡萄酒的品质, (Rom´an,S.M.等人,2022)使用TF-SPME技术测定葡萄汁中的挥发性成分分析。(M. N. Wieczorek等人,2022)使用两片不同涂层的TF-SPME薄膜先后提取啤酒中非极性和极性化合物风味物质,高性能提取宽极性范围化合物(log P=0.34~6.53)。
具体可阅读文章《1+1>2,分布TF-SPME法同时分析啤酒风味物质》(点击链接可查看往期推文)。
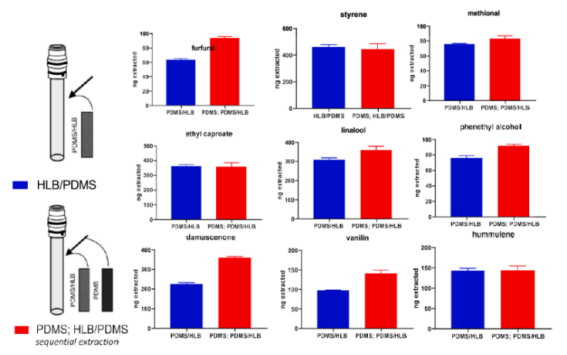
图5:分步TF-SPME提取啤酒VOCs
环境
TF-SPME技术特别适用于环境基质样品的现场采样,以解决恶劣环境的采样困难和减少采样、运输、储存、转移样品时带来的损失,同时可作为被动采样装置(TWA时间加权平衡采样)对流动的水体或空气污染物进行长期监控。
(Bragg等人, 2006;Qin等人,2009;F.Ahmadi,等人,2017;Jiang,R.2014)

TF-SPME已被广泛用于监测环境不同水体的污染物分析。
2003年,TF-SPME逐渐被用于以测定湖水的多环芳烃或地表水中的农药残留 (Bruheim等人,2003,H.Piri-Moghadam等人,2017)。萃取法升级!TF-SPME法分析地表水农残的效率翻倍(点击链接可查看往期推文)
2016年,在工厂附近的湖水检测出甲苯、二甲苯等污染物,借助薄膜固相微萃取PDMS/DVB涂层和Needle Trap动态捕集针两种技术,实现便携式GC-MS的现场采样和分析(Grandy,J.J.等人,2016)。(Boyac1,E.等人,2016)测定海水中的石油工业废弃物氟代苯甲酸(FBAs)。
2018年,诞生新的涂层PDMS/HLB现场萃取私人消毒热水池中的消毒副产物(Grandy等人,2018)。VOC神器?TF-SPME破解游泳池消毒副产物的秘密(点击链接可查看往期推文)
2020年,TF-SPME技术与无人机联用,现场采样水中的苯系物(Grandy等人,2020)。

图6:环境水体现场采样-无人机联用
生物样品
近年来,越来越多学者把SPME技术运用在活体/体内采样,TF-SPME也不例外。TF-SPME技术是一种简单的、非侵入性(无创)的挥发性有机物分析方法,被应用于分析皮肤、唾液、呼吸气体等样品,为疾病诊断提供新的可能性。
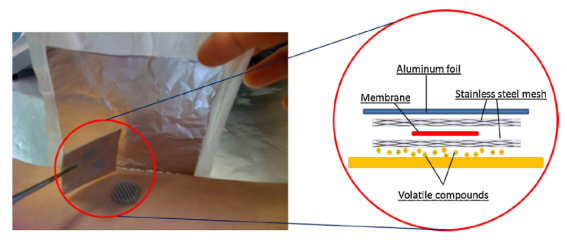
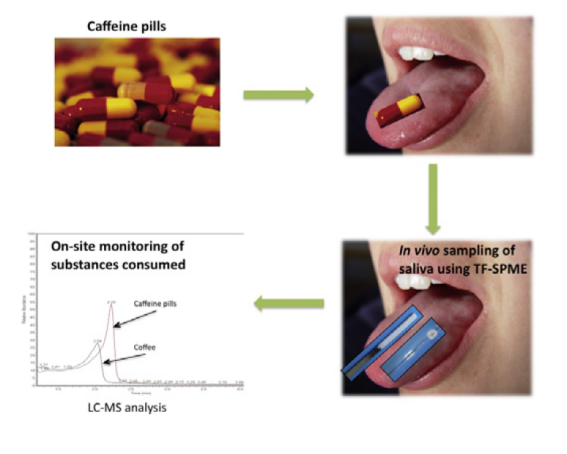
图7:皮肤&唾液活体采样
TF-SPME技术提取人体皮肤散发的VOCs成分和人体呼吸气体中的33种VOCs(R.Jiang,等人,2013,K. Murtada,等人2021)。同时使用TF-SPME和Blade两种薄膜(片)固相微萃取技术在人体内快速提取唾液样品5min,验证49种违禁物质和唾液中内源性类固醇(V.Bessonneau,等人,2015)。
生物体内散发的VOCs成分往往含量非常低,TF-SPME由于其较大表面积体积比,可以提供更高的萃取效率和灵敏度。
发展历程
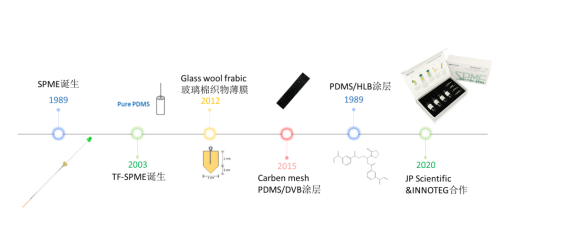

INNOTEG
英诺德
英诺德(INNOTEG)是一家专业从事科学仪器设备研发生产的高科技企业,是集实验室设备研发生产、方法开发、实验室仪器销售和技术服务为一体的专业厂家。
公司重视技术的研究和储备,一直保持高比例研发投入,创建了一支由博士、硕士和行业专家等构成的经验丰富,技术精湛的研发团队;与各大科研院所、高校合作,积极推进科技成果项目的产业化;同时,英诺德与国内外知名仪器设备厂家建立长期战略合作伙伴关系,为广大客户提供更多产品及一站式的解决方案。
参考文献
[1] M. Pilar Segura-Borrego, Rocío Ríos-Reina, Cristina Ubeda, Raquel M. Callejón ,M. Lourdes Morales, Foods ,2020, 9(6), 748.
[2] D.Gruszecka , J. Grandy , E.Gionfriddo, V.Singh ,J.Pawliszyn , Food Chemistry ,353 (2021) 129244.
[3] Sandra Marín-San Rom´an, Jos´e Miguel Carot, Itziar S´aenz de Urturi, Pilar Rubio-Bret´on,,Eva P. P´erez-´Alvarez , Teresa Garde-Cerd´an, Anal Chim Acta ,1226 (2022) 340254.
[4] M. N. Wieczorek , W.Zhou , J. Pawliszyn, Food Chemistry ,389 (2022) 133038.
[5] L. Bragg, Z. Qin, M. Alaee, J.Pawliszyn, J. Chromatogr. Sci,44(2016)317.
[6] Z. Qin, L. Bragg, G. Ouyang, V.H. Niri, J. Pawliszyn, J. Chromatogr. A. 1216 (2009) 6979.
[7] F.Ahmadi ,C, Sparham, E, Boyacı, J.Pawliszyn, Environ Sci Technol, ( 2017) 51(7):3929-3937.
[8] R. Jiang,J.Pawliszyn, Anal Chem, (2014)86(1):403-10.
[9] Bruheim, X. Liu, J. Pawliszyn, Anal. Chem. 75 (2003) 1002.
[10] H.Piri-Moghadam, E.Gionfriddo, A. Rodriguez-Lafuente ,J. J. Grandy, H. L. Lord , T. Obal , J. Pawliszyn, Anal Chim Acta ,964(2017)74-78.
[11] J.J. Grandy, E。Boyacı, J. Pawliszyn, Anal. Chem, (2016)88(3):1760-7.
[12] E.Boyacı, K. Gory´nsk, C. R. Viteri, J.Pawliszyn, J.Chromatography A, 1436 (2016) 51–58.
[13] J.J. Grandy, V.Singh, M.Lashgari, M.Gauthier, J.Pawliszyn, Anal Chem, 90(2018) 14072−14080.
[14] J. J. Grandy, V.Galpin, V.Singh, J.Pawliszyn, Anal Chem, (2020)92(19):12917-12924.
[15] R. Jiang, E.Cudjoe, B.Bojko, T.Abaffy, J. Pawliszyn, Anal Chim Acta 804 (2013) 111– 119.
[16] K. Murtada, V. Galpin, J.J. Grandy, V.Singh , F.Sanchez,J. Pawliszyn. Sustain Chem and Pharm 21 (2021) 100435.
[17] V.Bessonneau, E.Boyaci, , M.Maciazek-Jurczyk, J.Pawliszyn, Anal Chim Acta,856(2015)35-45.
*部分图片来源文献,旨在分享,如有侵权请联系删除










