甘露醇

甘露醇是一种糖醇,作为冻干注射剂中最常见的辅料之一,在小分子和大分子药物冻干制剂广泛应用,主要作用是用作填充剂。通常情况下,甘露醇会被添加到低浓度配方中,提高配方的浓度,有效防止冻干过程中产品向上或向外飘散,另外还能帮助形成机械强度高且外观优雅的冻干粉饼,这也是冻干产品的一个重要特性。
为什么甘露醇是一种受欢迎的填充剂?
★ 它是一种稳定的结晶性非吸湿性固体;
★ 它可溶于水,20℃时溶解度为18.6%w/w;
★ 它的化学性质稳定,作为非还原性糖醇,甘露醇不会与胺类发生美拉德反应;
★ 它在注射给药时不会产生不良反应。
1
甘露醇的物理形态及特点
甘露醇分为结晶态的无水甘露醇,无定形态的甘露醇以及甘露醇半水合物;其中结晶态的无水甘露醇又分为不同的晶型,β-、α-和δ-型,在常温条件下,β-型具有热力学最稳定性,其稳定性顺序为 β> α >δ。δ-型在绝对零度时保持热力学稳定。β-型与α-型呈单向转变相关性,而δ-型则与α-型和β-型存在对映异构关联。通过冷冻干燥水溶液获得的无水甘露醇形态,可能受溶质浓度及冷却速率、热处理等工艺参数的影响。无水甘露醇的物理形态似乎不会影响最终产品的质量特性。
在冷冻的水溶液中,甘露醇也可能形成半水合物的形式(MHH C₆H₁₄O₆0.5H₂O)。研究显示这种半水合物仅在低温下保持稳定<-20°C,在常温条件下,MHH是一种亚稳态水合物。它倾向于脱水并形成无水甘露醇。
预冻过程中形成的半水合物(MHH)若滞留在冻干制剂中,可能对最终产品性能产生影响:
① 若在冻干工艺中(未进行退火处理)出现MHH形成不一致的情况,可能影响生产工艺的可靠性;
② 若采用激进的干燥工艺脱除MHH的水分,可能引发活性药物成分(API)降解;
③ 储存期间晶格水的释放会显著影响制剂组分的理化稳定性。这些释放的水分会被非晶态组分吸附,导致玻璃化转变温度降低,进而增加反应活性或结晶倾向。
2
甘露醇与其它制剂组分的相互作用
在上市的产品配方中,有些产品辅料中除了甘露醇外,还会有其它的辅料物质,这就为甘露醇和其他辅料以及活性成分API之间提供了相互作用的可能性。这类相互作用可能影响甘露醇在冻干工艺各阶段及最终制剂中的物理形态,同时可能影响其他辅料的物理形态,进而影响最终产品的质量属性。
甘露醇与双糖相互作用
LYO INNOVATION
蔗糖和海藻糖是蛋白质及多肽冻干制剂中最常用的稳定剂。这两种糖的塌陷温度(Tc)相对较低,蔗糖为-32℃,海藻糖为-29℃。由于一次干燥过程需要在低于塌陷温度下进行,温度越低,干燥干燥时间会变得越长,此时如果添加甘露醇可形成部分结晶基质,从而为非晶相提供宏观“支撑”,若干燥温度超过Tc,非晶相会因结晶成分形成的刚性基质作用而产生难以察觉的粘性流动,这种成熟的方法已用在多种商业化制剂中,如Kepivance®, Leukine®, Enbrel®, Nplate®, Simulect®, Nulibry®等,在这些产品中,甘露醇与糖的比例通常≥2:1,虽然双糖作为稳定剂保护活性成分,但甘露醇的结晶会为无定形相提供支撑。
反过来,蔗糖和海藻糖对甘露醇的结晶具有浓度依赖性抑制作用,有研究表明:
① 在低甘露醇与蔗糖比例(≤1:1,w/w)时,蔗糖会抑制甘露醇在冷冻溶液中的结晶,而甘露醇仅在较高比例(>2:1)时才会结晶。当甘露醇与蔗糖比例为1:2时,即使经过退火处理,甘露醇仍保持无定形态。而在甘露醇与蔗糖比例为1:1时,甘露醇仅在退火后发生结晶。在含2:1比例甘露醇和蔗糖的配方中,甘露醇在冷冻过程中(以0.5℃/min速率)发生结晶。含有甘露醇和蔗糖的蛋白质配方也观察到类似现象;
② 当甘露醇与海藻糖的比例较低(≤1:2)时,甘露醇的结晶过程完全受阻,在冷冻溶液中保持无定形态。即使进行激进的退火处理(-18°℃下持续22h),这些配比下的甘露醇结晶仍无法实现。在中等比例(1:1或2:1)时,海藻糖在冷冻过程中抑制了甘露醇结晶。但后续退火处理会使甘露醇结晶形成,进而促进二水合海藻糖的结晶过程。值得注意的是,在3:1的高比例下,甘露醇反而发生结晶,此时海藻糖仍保持无定形态。
甘露醇与蛋白的相互作用
大多数蛋白质在冷冻浓缩过程中仍保持无定形态,并可能以浓度依赖的方式抑制甘露醇的结晶过程以及MMH的形成,Liao等人研究了在甘露醇和蔗糖3:1含量的配方中蛋白对甘露醇结晶的影响。该蛋白质对甘露醇结晶表现出浓度依赖性的抑制作用,且在蛋白质浓度≥30 mg/mL时效果显著。
反过来,甘露醇的结晶也可能会影响蛋白的稳定性,有研究通过使用乳酸脱氢酶(LDH)作为模型蛋白,冻干含甘露醇-蔗糖的配方体系中得到了验证。研究中,采用较低的蛋白质浓度(15 mg/mL)排除其自稳定的影响,同时确保即使在最低糖浓度(0.5% w/v)下仍能保持高糖蛋白比。通过改变甘露醇与蔗糖的比例(1:5至9:1)并引入退火步骤(-20°C,4h)到冻干工艺中,可调节甘露醇结晶程度。如预期所示,更高的甘露醇浓度和退火处理增强了结晶性。
此外,退火降低了酶活性回收率(4%至18%)。甘露醇结晶程度越高,酶活性回收率越低。含甘露醇制剂中残留酶活性的降低还伴随着蛋白质二级结构的变化。考虑到所有样品的糖蛋白比均>1,这种不稳定性不能归因于糖的浓度不足。但是,吐温PS80(0.01%w/v)的加入在冻干产品中保留了LDH的活性,同时,不影响甘露醇的形态或结晶度。
3
配方中含有甘露醇
会面临的潜在问题及应对策略
MHH的形成与预防
在典型的蛋白质配方中,当甘露醇与蔗糖的配比较低且退火温度低于-10°C时,这些因素会显著促进MHH的形成。如前面所述,甘露醇半水合物(MHH)的形成不仅会引发工艺稳健性问题,还可能对产品稳定性产生重大影响。即便仅有少量甘露醇以MHH形式残留,释放的水分也会导致顶空相对湿度显著升高,从而为蔗糖结晶创造有利条件,进而对蛋白的稳定性产生影响。
因此,通常建议是在冻干过程中二次干燥温度设置≥40℃以使充MHH充分脱水。第二个方案则是将产品置于冷藏环境中储存,以充分延缓MHH的脱水过程,但是这个方案通常不是我所期望的。另外,也有个别研究表明,储存期间MHH脱水没有影响到蛋白质的稳定性。当观察到成品冻干粉中存在MHH的情况下,需要谨慎确定MHH脱水对产品稳定性的影响。
鉴于MHH对蛋白属性的影响,我们可以通过提高退火温度(> -10°C)或通过控制冰晶成核过程,可以实现无水甘露醇的结晶,即有效抑制甘露出半水合物MHH的形成。在生产工艺实施前,可通过差示扫描量热法(DSC)和X射线衍射法(XRD)系统研究这两种方法对甘露醇结晶行为的影响,确保在整个过程中没有MHH的形成和存在。
破瓶现象
冻干工艺中含有甘露醇的制剂易发生碎瓶现象,可能导致药品损失、清理溢出物的额外成本,以及需要延长检查时间以确保所有破裂小瓶被及时丢弃。
实验观察到小瓶破损现象在冷冻和升温过程中均有发生,其严重程度取决于甘露醇浓度与温度变化速率。快速冻融循环结合高浓度的甘露醇(15% w/v)会导致小瓶破损率显著上升,而缓慢升温速率搭配低浓度甘露醇(5%w/v)则能大幅降低破瓶的风险。破瓶主要源于冷冻过程中药物膨胀产生的内部应力。当甘露醇未充分结晶,在升温过程中,与其结合的水被释放并结晶,冰的密度为0.92 g/cm³,而水的密度约为1.0 g/cm³(在0°C时)。当水结晶成冰时,体积会增加9%,这种体积突变可能会超过瓶子的抗压强度,从而引发碎瓶。
通过调整降温速率,使其进行缓慢冷却,降低灌装量以及进行退火处理等来有效减少破瓶的风险。根据FDA,在对冻干注射产品的申请进行审查时,一个常见的缺陷是关于退火步骤降低药瓶破损风险(美国食品药品监督管理局药品生产评估办公室OPMA)。原文是” A representative comment: “It is noted that annealing step is not included in your proposed lyophilization cycle although crystalization of mannitol during freezing is critical to minimizing the risk of vial breakage. Comment on what controls, if any, have been put into place to mitigate the risk associated with vial breakage during lyophilization and storage”代表性意见指出:“需注意的是,虽然甘露醇在冷冻过程中结晶对降低药瓶破损风险至关重要,但贵司拟定的冻干工艺流程中并未包含退火步骤。请说明是否已采取相关控制措施来降低冻干及储存过程中药瓶破损的风险。
瓶内异质性
高灌装体积/高度的药品冻干存在显著挑战,当预冻溶液中的溶质浓度较高时,这些挑战会更加严峻。一个可能的后果是最终产品在瓶内的不均匀性。当含有甘露醇的配方进行冻干时,其物理形态呈现异质性特征。通过同步辐射X射线衍射技术对甘露醇-蔗糖/海藻糖溶液(10% w/v;蛋糕高度2cm)制备的冻干制剂进行垂直剖面分析显示:冻干机顶部和底部的MHH含量较低,而向中心区域显著增加。这一现象表明,冻干制剂中可能存在高MHH含量的特定区域,不同区域的活性药物成,从而导致瓶内药物稳定性的不均一性,可通过退火处理来消除这种异质性。
总结
LYO INNOVATION
作为冻干制剂(小分子和大分子药物)中的辅料,甘露醇可有效实现两大目标:
① 通过高温进行一次干燥,大幅缩短冻干时间并降低成本;
② 形成机械强度高且外观优雅的冻干制剂。
但需注意确保最终产品中甘露醇完全结晶,可通过引入退火步骤实现,引入退火步骤以达到以下目的:
① 降低药瓶破损风险;
② 使冻干制剂的干燥行为和组成趋于均一;
③ 减少储存期间甘露醇结晶的风险。
当用于大分子药物配方时,甘露醇与二糖(蔗糖或海藻糖)≥2:1的比例可以确保甘露醇结晶,并使一次干燥更快,而冻干保护剂保持无定形并稳定蛋白质。配方中加入甘露醇可能与以下问题有关:
① 小瓶破损。可通过适当选择制剂成分和组成、灌装高度、小瓶尺寸、冷却速率、退火温度和时间来预防;
② 亚稳态甘露醇半水合物MHH的形成与保留。在这种情况下,选择适当的退火温度和时间以避免半水合物的形成,并尽可能通过在高温(≥40℃)下进行二次干燥来确保完全脱水。但是需要注意,只有当API不具有热不稳定性时,才有可能实现这一点。
尽管研究表明甘露醇还具有其它功能性,比如无定形态保护剂,复水性能增强剂,渗透压调节剂等,但它目前仍然还是冻干制剂中首选的填充剂,在使用过程中,我们需要精心“驾驭”,充分理解其特性,精准把控配方及工艺参数,才能扬长避短,让它真正成为打造高质量冻干产品的利器。
参考文献
1.Mehta M, Bhardwaj SP, Suryanarayanan R. Controlling the physical form of mannitol in freeze-dried systems. Eur J Pharm Biopharm. 2013;85(2):207–213.
2.Romero-Torres S, Wikstrom H, Grant ER, Taylor LS. Monitoring of mannitol phase behavior during freeze-drying using non-invasive raman spectroscopy. PDA J Pharm Sci Technol. 2007;61(2):131–145.
3.Dierks TM, Korter TM. Origins of the relative stabilities of anhydrous and hydrated D-mannitol crystals. J Phys Chem A.2016;A120:6629–6636.
4.Srinivasan JM, Wegiel LA, Hardwick LM, Nail SL. The influence of mannitol hemihydrate on the secondary drying dynamics of a protein formulation: a case study. J Pharm Sci. 2017;106:3583–3590.
5.Tang X, Pikal MJ. Design of freeze-drying processes for pharmaceuticals: practical advice. Pharm Res. 2004;21:191–200.
6.Mullin JW. Crystallization. Oxford: Butterworth-Heinemann Ltd.; 2001.
7.Sheskey PJ, Hancock BC, Moss GP, Goldfarb DJ. Mannitol. Handbook of Pharmaceutical Excipients. 9th London: Pharmaceutical Press; 2020:647–652.
8.Bhatnagar BS, Tchessalov S, Lewis LM, Johnson R. Freeze drying of biologics. Encyclopedia of Pharmaceutical Technology. CRC Press; 2013:1673–1722.
9..Larsen H, Trnka H, Grohganz H. Formation of mannitol hemihydrate in freezedried proteinformulations—a design of experiment approach. Int J Pharm. 2014;460:45–52.
10.Pyne A, Chatterjee K, Suryanarayanan R. Solute crystallization in mannitol −glycine systems—implications on protein stabilization in freeze-dried formulations. J Pharm Sci. 2003;92:2272–2283.
11.Badal Tejedor M, Fransson J, Millqvist-Fureby A. Freeze-dried cake structural and physical heterogeneity in relation to freeze-drying cycle parameters. Int J Pharm. 2020;590: 119891.
12.Williams NA, Dean T. Vial breakage by frozen mannitol solutions: correlation with thermal characteristics and effect of stereoisomerism, additives, and vial configuration. J Parenter Sci Technol. 1991;45:94–100.
13.Williams NA, Lee Y, Polli GP, Jennings TA. The effects of cooling rate on solid phase transitions and associated vial breakage occurring in frozen mannitol solutions. J Parenter Sci Technol. 1986;40(4):135–141.
14.Jiang G, Akers M, Jain M, et al. Mechanistic studies of glass vial breakage for frozen formulations. I. Vial breakage caused by crystallizable excipient mannitol. PDA J Pharm Sci Technol. 2007;61(6):441–451.
15.Rhieu SY, Anderson DD, Janoria K. A regulatory perspective on manufacturing processes pertaining to lyophilized injectable products. AAPS J. 2020;22(5):100.
16.Thakral S, Koranne S, Suryanarayanan R. Intra-vial heterogeneity in physical form of mannitol in colyophilized binary systems. Pharm Res. 2018;35(11):214.
莱奥德创冻干工场——提供开放式的冻干平台,助力生物医药企业加速研发与产业化进程!
✦
莱奥德创冻干工厂
技术优势
✦
核心优势
先进的冻干设备和软件(PATs),领先的冻干理念与技术 (QbD,Line of Sight )
● SMART™ 自动化工艺摸索技术,为产品提供数据支持的初步工艺;
● ControLyo® 可控瞬时成核技术,对成核温度进行精确控制,确保产品均一性;
● LyoFlux® TDLAS技术,对蒸汽质量流量进行精确测量,精确判定冻干终点;
● Tempris® 无线温度传感器,提供产品温度实时监测与记录;
● Biopharma 冻干前后分析技术,对产品配方进行特征研究,避免冻干过程开发风险。
冻干工艺开发


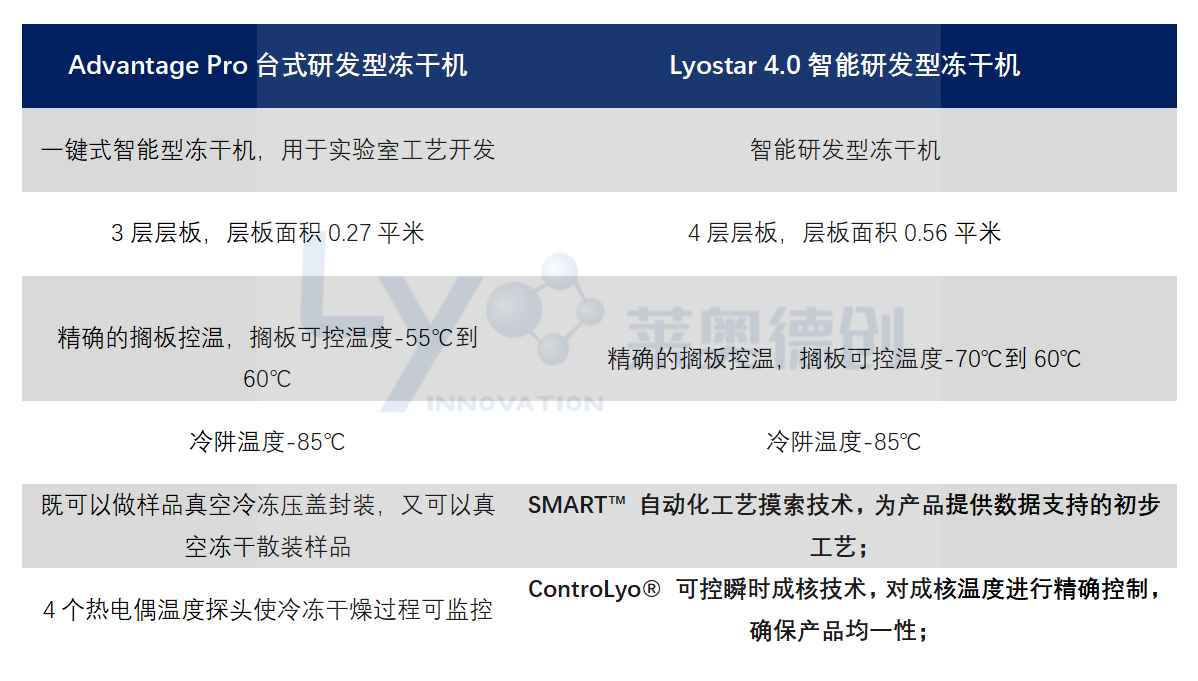
冻干前后产品性能分析
(点击查看大图)

如果您对上述服务感兴趣,可随时联系德祥科技或莱奥德创,可拨打热线400-006-9696,或扫码填写表单咨询。

关于莱奥德创冻干工场
上海莱奥德创生物科技有限公司专注于提供先进的冻干设备应用和制剂开发相关服务,依托于合作伙伴加拿大ATS集团SP品牌和英国Biopharma Group等的紧密合作,致力于促进中国生物医药技术创新升级,助力中国大健康行业的持续发展。莱奥德创在上海及广州设有实验室,拥有专业的技术团队及国内外专家支持体系。
莱奥德创面向生物制药、食品科学等各个领域行业客户,提供冻干研发、放大、委托生产及培训等服务。
前期研发
● 产品配方特征研究:共晶点温度(Te)、塌陷温度(Tc)、玻璃态转化温度(Tg'、Tg)测定等;
● 实验室工艺开发:冻干工艺开发:冻干制剂配方开发,工艺确定,申报材料撰写;
● 冻干工艺优化:利用中试冻干机上独家PAT工具优化及缩短工艺;
● 冻干产品质量指标测试:水分含量,冻干饼韧度分析;
● 咨询服务:如产品外观问题、产品质量问题、其他troubleshooting等;
工艺放大/技术转移
● 冻干工艺转移/放大: 远程技术指导+现场服务;
● 小批量冻干生产(NON-GMP),临床一期生产(GMP);
其他业务
● 企业小团队线上线下培训服务:冻干原理,工艺开发,设备使用维护等;
● 冻干设备租赁服务。
400-006-9696
www.lyoinnovation.com
莱奥德创冻干工场
中国(上海)自由贸易试验区富特南路215号
自贸壹号生命科技产业园4号楼1单元1层1002室
德祥科技
德祥科技有限公司成立于1992年,总部位于中国香港特别行政区,分别在越南、广州、上海、北京设立分公司。主要服务于大中华区和亚太地区——在亚太地区有27个办事处和销售网点,5个维修中心和2个样机实验室。
30多年来,德祥一直深耕于科学仪器行业,主营产品有实验室分析仪器、工业检测仪器及过程控制设备,致力于为新老客户提供更完善的解决方案。公司业务包含仪器代理,维修售后,实验室咨询与规划,CRO冻干工艺开发服务以及自主产品研发、生产、销售、售后。与高校、科研院所、政府机构、检验机构及知名企业保持密切合作,服务客户覆盖制药、医疗、商业实验室、工业、环保、石化、食品饮料和电子等各个行业及领域。
2009至2021年间,德祥先后荣获了“最具影响力经销商”、“年度最佳代理商“、”年度最高销售奖“等殊荣。我们始终秉承诚信经营的理念,致力于成为优秀的科学仪器供应商,为此我们从未停止前进的脚步。
我们始终相信,每一天都在使这个世界变得更美好!










