研究说明
本研究旨在评估冷冻对高灌装深度浓缩制剂冻干的影响。
本研究使用30 mL西林瓶中灌装15 mL的15% (w/w) 磺丁基醚-7-β-环糊精溶液。在该模型系统的冻干过程中,使用了各种冷冻方法,包括一步冷冻、两步过冷冷冻、退火、真空诱导冷冻、使用叔丁醇改变冰晶习性、碘化银诱导冰核,以及其中一些冷冻方法的组合。
这项工作表明,冷冻过程对高灌装深度浓缩制剂的一次干燥速率和产品质量有显著影响。退火、真空诱导冷冻以及在配方中添加TBA或冰核剂均加速了后续的冰升华过程。两步冷冻或添加TBA通过消除饼块内的垂直异质性改善了产品质量。两步冷冻结合退火步骤被证明是高灌装深度产品冻干过程中首选的冷冻方法。除了是一种有效的冷冻方法外,它也最适合于放大生产。另一种方法是在配方中添加一定量的TBA,前提是能够证明TBA与配方的相互作用或监管方面的问题不存在。本研究中进行的西林瓶尺寸评估表明,虽然使用大直径西林瓶以减少灌装深度可以大大缩短单个批次的循环时间,但这将显著降低大规模冻干机的产品产能。
Q
为什么冷冻是冷冻干燥过程中关键的一步?
A
制剂溶液的冻结开始于冰成核,随后是冰生长。在冷冻阶段,大部分水通过玻璃态和/或结晶溶质的基质分离成冰晶。由于用于注射剂型的制剂溶液是经过过滤的,并且相对不含悬浮杂质,因此在冷冻过程中通常会发生过冷,并且通常在低于平衡冰点10至15°C的范围内观察到冰核。[通过控制搁板温度(设定点、升温速率等)、小瓶中制剂的特性(例如制剂成分、浓度、填充体积/深度)以及玻璃小瓶的内表面特性来确定冰形成过程。在冷冻过程中形成的冰和溶质的微观结构强烈地影响随后的一次干燥和二次干燥,并最终影响冻干产品的质量。因此,冷冻是冷冻干燥过程中非常关键的一步。大多数冷冻干燥循环开发工作集中在一次干燥阶段,即在不降低产品质量的情况下缩短一次干燥时间,在研究冷冻干燥工艺开发中冷冻的影响方面所做的工作相对较少。
环糊精衍生物,特别是2-羟丙基-β-环糊精(HPCD)和磺丁基醚-β-环糊精(SBECD),已越来越多地用作冻干胃肠外制剂赋形剂,因为它们对包括小分子、肽和蛋白质在内的各种分子具有有效的溶解和稳定作用。通常,在这些制剂中需要相对较高的环糊精浓度(10%-20%),并且通常,应用相对高的填充体积以满足制剂剂量要求。在这项工作中,选择在30毫升的小瓶中装入15毫升的15%SBECD溶液进行冷冻干燥,该小瓶具有相对较高的填充深度(约2.8厘米)。在该模型系统的冷冻干燥中使用了不同的冷冻方法,并评价了它们对一次干燥速率和产品质量的影响。讨论了这些冷冻方法在冻干产品开发和生产中的实用性。此外,还进行了使用小直径小瓶(30 mL)与使用大直径小瓶(50 mL)的比较研究,以评估大型冷冻干燥机中高填充体积产品的通量。
1
冷冻干燥程序
在中试规模的冻干机中进行冷冻干燥。将15mL溶液灌装到30mL管状小瓶(约2.8cm填充深度)或50mL模制小瓶(约1.3cm填充深度)。每批次装载冻干机的两个搁板,每板约200个30 mL西林瓶或100个50 mL西林瓶。

本研究中所有批次的冷冻干燥循环参数均保持一致,但所采用的冷冻方法和初步干燥期间的搁板温度除外。表中描述了每批所用的工艺条件。冷冻后,根据电容压力计的测量结果,将腔室抽真空并控制在90mTorr,同时以0.5℃/min的升温速率将搁板温度从-45℃升至-10或0℃(见表1)。通过压升测试确定冰升华结束时,以0.1℃/min的升温速率将搁板温度升高至40℃,并保持6小时。

图1:单步(慢速)冷冻过程的冷冻行为。A:冰层断裂并上浮;B. 形成密集浓缩核心

图2 两步冷冻过程的冷冻行为。照片A:过冷保温后快速冷冻;照片B:均匀的冰形成
2
冻结行为的视觉观察
观察到不同冷冻方法产生的冷冻行为的实质性差异。在一步(缓慢)冷冻过程中,冰核从小瓶的底部边缘开始,并增长到大约填充深度的三分之一。随后一些冰断裂并上升到顶部(图1A),导致冰从顶部和底部向中部生长。因此,形成了浓缩核心(图1B)。
在两步冷冻过程中,由于小瓶中的配方首先被冷却至-10°C(高于冰核温度)并达到平衡,因此产品在整个溶液中保持过冷状态。当搁板温度快速下降时,发生快速冻结(图2A),在整个溶液中形成相对均匀的冰(图2B)。
虽然含5%TBA的配方中的冰核温度与不含TBA的配方中的冰核温度没有显著差异,但TBA的存在改变了冰的习性。大的针状冰晶比对照中的晶体形成和生长得更快。

图3:单步冷冻工艺的SBECD+5%TBA的冷冻行为照片A:冰晶脱离并浮起;照片B:快速自上而下冻结

图4:真空诱导冻结过程的冻结行为。照片A:填充顶面的冰核;照片B:自上而下的冻结
此外,在五分之四的观测样本中,从西林瓶底边缘成核并生长的冰晶会迅速脱落并上浮至灌装液顶部(图3A),引发自上而下的快速冻结过程(图3B)。这种特殊现象在含叔丁醇制剂的冷冻干燥过程中尚未见报道。虽然大型针状冰晶加速了一次干燥进程,但自上而下冻结形成的冰结构可能是另一个影响因素。
在真空诱导冷冻实验中,西林瓶内溶液首先在-10°C环境下进行平衡。当真空度降至600毫托时,液体表面因蒸发降温引发顶部冰核形成(图4A),随即触发自上而下冻结(图4B)。随着冰晶持续生长,形成了相对粗大的垂直冰晶结构。当搁板温度以超过1°C/分钟的速率快速降至-45°C并保持时,溶液进一步固化。研究发现,对于高浓度大灌装深度的制剂,在真空诱导冷冻前将产品维持在-10°C是实现均匀冷冻的关键步骤。若按文献方法在5°C条件下进行预处理,由于蒸发吸热不足以降低底部溶液温度,冰层仅能在顶部形成而无法向下延伸。此种情况下,若真空持续时间超过5分钟,瓶内会发生"喷涌"现象——即未冻结部分溶液沸腾冲开冻结表层。如果降低搁板温度,会观察到两层固化(一层来自真空诱导冷冻,另一层来自搁板冷却),并且在干燥后观察到饼状物在中间断裂。

图5:单步冷冻工艺含AgI的SBECD的冷冻行为。照片A:冰从底部向顶部生长;照片B:树枝状冰晶的形成
在SBECD配方中加入少量的AgI(冰核剂)大大降低了过冷,冰核温度提高到约-2°C,如连接在小瓶外表面的热电偶所示。观察到冰从底部向顶部生长(图5A)。在这种情况下,观察到典型的树枝状冰晶(图5B)。
3
控制批次:确定冰升华终点(一次干燥)
在对照批次(批次I)中,使用了药品冷冻干燥生产中典型的冷冻工艺:[5]以0.3°C/min的速度将搁板温度从5°C降至-45°C,并保持3小时,以确保所有小瓶中的产品完全冷冻和固化。
在一次干燥阶段进行了升压试验(PRT),但在该批次中PRT的控制功能失效。产品室和冷凝器之间的隔离阀的最大关闭时间设定为20秒,最大压力上升设定为20毫托,以使压力上升对冷冻干燥条件的扰动最小,并为测试提供足够的灵敏度。第一干燥阶段持续到所有过程变量指示冰升华完成的点,然后手动推进到第二干燥阶段。
这一批的周期时间确实很长,持续了4天多。建立了压力上升和其他过程变量之间的相关性,包括热电偶测量的产品温度、比较压力(电容压力计与皮拉尼压力计)、腔室和冷凝器之间的压降、N2流速和冷凝器盘管温度(见图6)。结果,建立了隔离阀每20秒关闭时间4毫托的压力上升标准,用于确定冰升华(一次干燥)的终点,并用于自动控制所有其他批次中从一次干燥到二次干燥的循环推进,但批次#VIII除外,其由产品温度确定。这意味着,如果在测试期间压力上升小于每分钟12毫托,则冰升华应该完成。
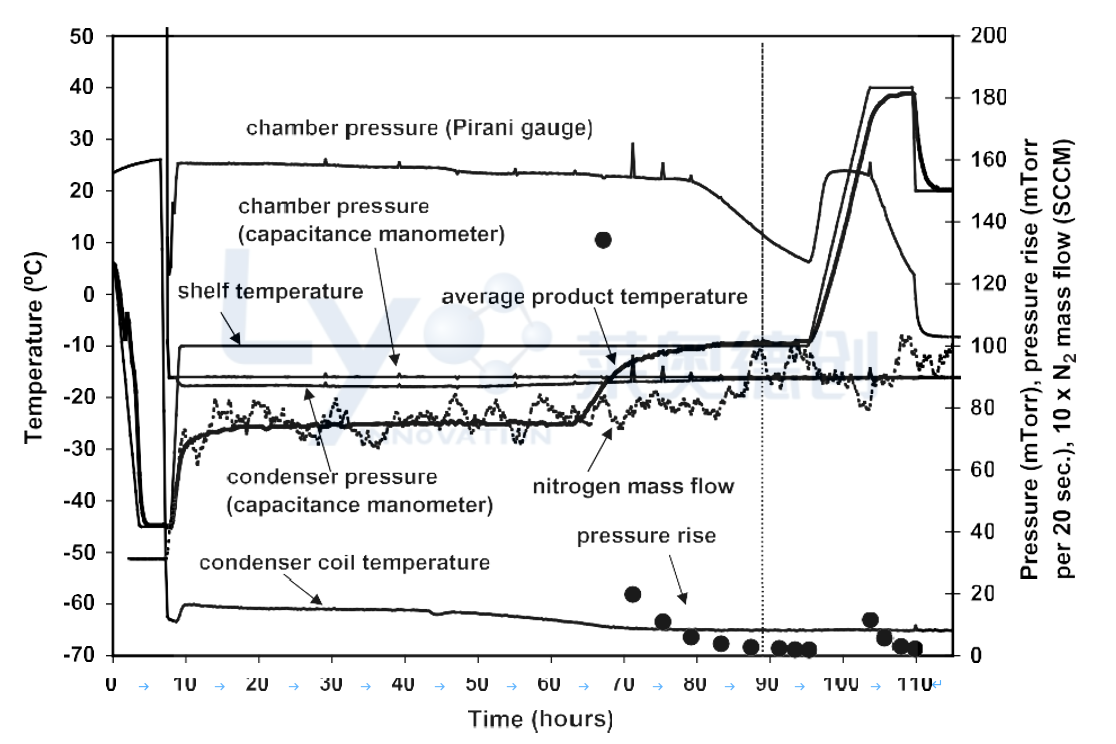
图6:对照批次的冷冻干燥工艺概况
4
冷冻工艺对蛋糕外观的影响
蛋糕的外观取决于冷冻形成的固体基质结构是否能够完好保持。若产品温度过高,该结构在一次干燥和/或二次干燥过程中可能发生变形。
单步冷冻批次(批次I)生产的蛋糕底部略有收缩,中间的纹理不规则。这种不规则性对应于在冷冻阶段形成的集中核心。通过两步冷冻消除了不规则性。添加退火步骤导致更均匀的饼状外观。来自真空诱导冷冻批料的饼的顶部比底部具有更多的收缩。含有成核剂AgI的批料产生了条纹状的饼状外观。两步冷冻结合退火或在配方中添加5%TBA产生最美观的蛋糕。在50毫升模制小瓶中干燥的滤饼比在30毫升管状小瓶中干燥的滤饼表现出更大的收缩。
5
冻结过程对垂直均匀性的影响
固体基质结构由冷冻过程决定,该过程包含冰晶成核与晶体生长两个阶段。由于西林瓶内配方溶液中的水分含量是固定的,冰晶成核速率(决定冰核总数)与晶体生长速率之间形成的竞争关系,会导致溶质(辅料和活性分子)在瓶内形成特定分布模式,这种分布最终体现为瓶内均匀性。
在单步冷冻过程中,当晶体生长速率快于冰晶成核速率时,会形成较大的冰晶体。然而这种冷冻方式会导致溶质分布不均。正如冷冻行为观察所示,这种情况在高灌装深度的浓缩溶液中会加剧,导致冷冻阶段在溶液中心形成浓缩核心。这种不均匀性不仅会大幅增加后续一次干燥的难度,还可能引发终产品的潜在质量问题。
瓶内溶质分布不均会通过改变辅料的稳定效果,对药物分子(特别是蛋白质分子)造成不利影响,可能诱发缓冲组分结晶,导致瓶内水分分布不均等问题。反之,若冰核形成速率大于冰晶生长速率,样品中会形成近乎瞬时的冰晶,从而实现溶质在瓶内的均匀分布。
目前针对瓶内不均匀性问题的关注仍显不足,相关文献报道也十分有限。对于高浓度、大灌装深度的制剂冷冻干燥而言,这一问题(特别是垂直均匀性)显得尤为关键。三段重量分析法结果(见图7)证实:单步冷冻会在干燥产品中形成高度垂直不均匀性,其中部出现高浓度核心,而添加碘化银可部分改善此现象。通过采用两步冷冻法(包含过冷保持阶段)或添加叔丁醇,可获得最佳的瓶内均匀性。
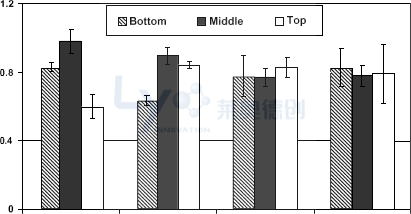
图7:冻干蛋糕的垂直均匀度
6
冷冻过程对干燥产品水分含量的影响
含水量数据汇总于下表。退火处理、两步冷冻及真空诱导冷冻会使冷冻干燥产品的含水量略有上升,而添加碘化银的干燥饼块含水量则增加了一倍。这可能是由于这些冷冻方式增大了冰晶尺寸和/或形成了互联冰晶结构,从而减少了总表面积,导致二次干燥阶段的解吸速率降低。尽管添加叔丁醇改变了冰晶形态,但有趣的是,批次IX的含水量与对照组并无显著差异。批次IX的实验结果表明,在此案例中更换更大规格的西林瓶并未对终产品含水量产生影响。

7
冷冻过程对一次干燥时间的影响
由于制剂在冷冻态和干燥固态的微观结构均由冷冻过程中的冰晶形成决定,冰晶升华速率深受冷冻工艺影响。
在搁板温度均控制在-10°C的批次中,一次干燥时间按以下顺序递减:单步冷冻(批次I)> 两步冷冻(批次IV)> 添加碘化银(批次X-A)> 真空诱导冷冻(批次VII)> 两步冷冻结合-10°C退火(批次V)≈ -10°C退火(批次II)> 两步冷冻结合-2.5°C退火(批次VI)≈ -2.5°C退火(批次III)> 真空诱导冷冻结合退火(批次VIII)> 添加叔丁醇(批次IX-A)。
虽然冷冻方式改变带来的传质阻力提升能加速冰晶升华速率,但在固定搁板温度和腔室压力时,这同时会降低产品温度,从而削弱对一次干燥时间的缩减效果。加速一次干燥速率的主要限制因素在于产品温度必须始终低于塌陷温度(Tc)。因此评估不同冷冻方法的优势时,采用与对照组相同产品温度和腔室压力(Tp, Pc)条件下的一次干燥时间节省量作为指标,比使用相同搁板温度和腔室压力(Ts, Pc)的条件更具可比性。
8
冷冻方法在注射用药品研发生产中实际应用价值
本研究结果表明,对于高浓度大灌装深度的制剂冷冻干燥过程,冷冻工艺显著影响一次干燥速率和产品质量。通过改变冰晶尺寸、结构及冰晶间互联性(采用退火、真空诱导冷冻或添加冰核剂碘化银),调整冰晶形态(添加叔丁醇),或改变冰晶分布模式(采用两步冷冻),均可大幅加速冰晶升华过程。
在注射制剂冷冻干燥中添加叔丁醇已引发制药领域日益浓厚的兴趣。本研究表明,添加叔丁醇不仅能显著加速高灌装深度产品的一次干燥速率,同时能有效降低饼块不均匀性。只要不存在叔丁醇与处方的相互作用及注册监管问题,该方法可作为优化工艺、提升产品质量的重要策略。
如批次II和III所示,冰晶退火处理能有效降低水蒸气传质阻力,进而提升冰晶升华速率。但退火处理无法解决瓶内不均匀性问题。采用过冷保持的两步冷冻法不仅能制备均匀度良好的饼块,同时可提高一次干燥速率。若将两步冷冻与退火工艺联用,可进一步加速干燥进程,且制得的饼块兼具美观外形与高度均匀性。
结论
冷冻工艺对一次干燥速率及产品质量的影响,在高浓度和/或大灌装深度的制剂中尤为显著。
退火处理、真空诱导冷冻、添加叔丁醇或冰核剂(碘化银)均能加速后续冰晶升华过程。两步冷冻法或添加叔丁醇则可通过消除饼块垂直方向的不均匀性来提升产品质量。因此,对于大灌装深度产品的冷冻干燥,两步冷冻结合退火的联用方案可作为优选冷冻方案。该方案不仅是高效冷冻方法,更具备良好的工艺放大适用性。
若能证实叔丁醇与处方不存在相互作用且符合监管要求,在处方中添加适量叔丁醇是另一种有效替代方案。采用大直径西林瓶虽可通过降低灌装深度显著缩短生产周期,但会大幅降低工业化冻干机的批次产量。
* 本文译自论文“A Study of the Impact of Freezing on the Lyophilization of a Concentrated Formulation with a High Fill Depth”如需原文,请联系莱奥德创400-006-9696。
莱奥德创冻干工场——提供开放式的冻干平台,助力生物医药企业加速研发与产业化进程!
✦
莱奥德创冻干工厂
技术优势
✦
核心优势
先进的冻干设备和软件(PATs),领先的冻干理念与技术 (QbD,Line of Sight )
● SMART™ 自动化工艺摸索技术,为产品提供数据支持的初步工艺;
● ControLyo® 可控瞬时成核技术,对成核温度进行精确控制,确保产品均一性;
● LyoFlux® TDLAS技术,对蒸汽质量流量进行精确测量,精确判定冻干终点;
● Tempris® 无线温度传感器,提供产品温度实时监测与记录;
● Biopharma 冻干前后分析技术,对产品配方进行特征研究,避免冻干过程开发风险。
冻干工艺开发


(点击查看大图)
冻干前后产品性能分析
(点击查看大图)

如果您对上述服务感兴趣,可随时联系德祥科技或莱奥德创,可拨打热线400-006-9696,或扫码填写表单咨询。

关于莱奥德创冻干工场
上海莱奥德创生物科技有限公司专注于提供先进的冻干设备应用和制剂开发相关服务,依托于合作伙伴加拿大ATS集团SP品牌和英国Biopharma Group等的紧密合作,致力于促进中国生物医药技术创新升级,助力中国大健康行业的持续发展。莱奥德创在上海及广州设有实验室,拥有专业的技术团队及国内外专家支持体系。
莱奥德创面向生物制药、食品科学等各个领域行业客户,提供冻干研发、放大、委托生产及培训等服务。
前期研发
● 产品配方特征研究:共晶点温度(Te)、塌陷温度(Tc)、玻璃态转化温度(Tg'、Tg)测定等;
● 实验室工艺开发:冻干工艺开发:冻干制剂配方开发,工艺确定,申报材料撰写;
● 冻干工艺优化:利用中试冻干机上独家PAT工具优化及缩短工艺;
● 冻干产品质量指标测试:水分含量,冻干饼韧度分析;
● 咨询服务:如产品外观问题、产品质量问题、其他troubleshooting等;
工艺放大/技术转移
● 冻干工艺转移/放大: 远程技术指导+现场服务;
● 小批量冻干生产(NON-GMP),临床一期生产(GMP);
其他业务
● 企业小团队线上线下培训服务:冻干原理,工艺开发,设备使用维护等;
● 冻干设备租赁服务。
400-006-9696
www.lyoinnovation.com
莱奥德创冻干工场
中国(上海)自由贸易试验区富特南路215号
自贸壹号生命科技产业园4号楼1单元1层1002室
德祥科技
德祥科技有限公司成立于1992年,总部位于中国香港特别行政区,分别在越南、广州、上海、北京设立分公司。主要服务于大中华区和亚太地区——在亚太地区有27个办事处和销售网点,5个维修中心和2个样机实验室。
30多年来,德祥一直深耕于科学仪器行业,主营产品有实验室分析仪器、工业检测仪器及过程控制设备,致力于为新老客户提供更完善的解决方案。公司业务包含仪器代理,维修售后,实验室咨询与规划,CRO冻干工艺开发服务以及自主产品研发、生产、销售、售后。与高校、科研院所、政府机构、检验机构及知名企业保持密切合作,服务客户覆盖制药、医疗、商业实验室、工业、环保、石化、食品饮料和电子等各个行业及领域。
2009至2021年间,德祥先后荣获了“最具影响力经销商”、“年度最佳代理商“、”年度最高销售奖“等殊荣。我们始终秉承诚信经营的理念,致力于成为优秀的科学仪器供应商,为此我们从未停止前进的脚步。
我们始终相信,每一天都在使这个世界变得更美好!










